长春假疫苗案引爆网络 谁是疫苗之王背后的黑手?(组图)
北京时间7月22日,中国国家药监局出手清理,通告直指长生生物(002680.SZ)编造生产记录和产品检验记录,随意变更工艺参数和设备,责令该企业停止生产,收回狂犬疫苗药品GMP证书,召回尚未使用的相关疫苗。与此同时,中国国务院总理李克强就疫苗事件作出批示:此次疫苗事件突破人的道德底线,必须给全国人民一个明明白白的交代。
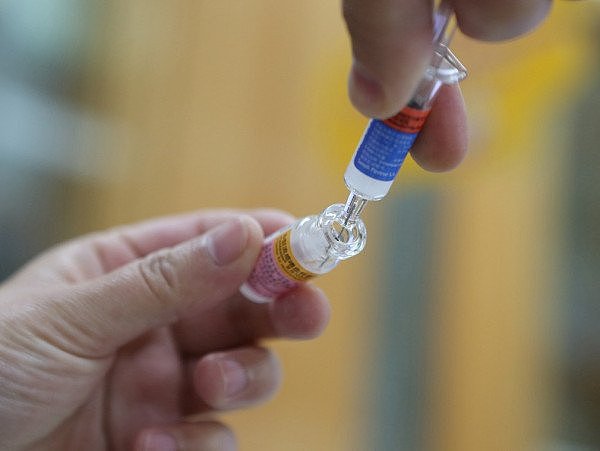
中国再现“问题疫苗 ”民众恐慌情绪蔓延(图源:VCG)
近日,中国一起“疫苗事件”在国家内部引起轩然大波, 事件起源于7月15日下午,中国国家药品监督管理局发布公告,公告显示,国家药品监督管理局组织对长春长生开展飞行检查,发现该企业冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为。随后中国自媒体发出一篇《疫苗之王》的文章,进一步点燃了大众的怒火,媒体、自媒体纷纷跟进报道转发,疫苗问题也逐渐被摆上退无可退的台面,愤怒的公众都在等待一个结果,因为这一次事件又关乎孩子,也几乎波及每一个中国人。不过该文章在7月22日遭全网删除,长春长生宣称文章报道有诸多不实之处。
到底谁在作恶?监管又在哪里?
据腾讯《棱镜》的深入调查,长生生物在2015年借壳黄海机械上市,本质上依旧是一家家族企业。董事长高俊芳还另外出任四项职位,包括董事、法定代表人、总经理和财务总监,而长生生物现任副总经理兼销售总监张友奎是高俊芳的丈夫,其子张洺豪则担任长生生物的副董事长、副总经理、执行董事。此外,张友奎两个妹妹张敏和张雯,同样位列该公司十大股东,前者持有1.24%的股份,后者通过长春市祥升投资管理有限公司持股3.02%。
正是这家家族企业,在过去六年时间里,往市场销售疫苗超过1.1亿支,由此录得净利润17.5亿元(1元人民币约合0.15美元)。这些疫苗最终销售地系中国各地的疾控中心、防疫站,而后再注入接种者的身体。
北京时间7月22日晚间,中国国家药监局宣布一则通告,直指长生生物(002680.SZ)编造生产记录和产品检验记录,随意变更工艺参数和设备,责令该企业停止生产,收回狂犬疫苗药品GMP证书,召回尚未使用的相关疫苗,同时国家药监局还表示,将组织对所有疫苗生产企业进行飞行检查。7月23日,据中国政府网消息,中国国家总理李克强对此也表态:此次疫苗事件突破人的道德底线,必须给全国人民一个明明白白的交代。
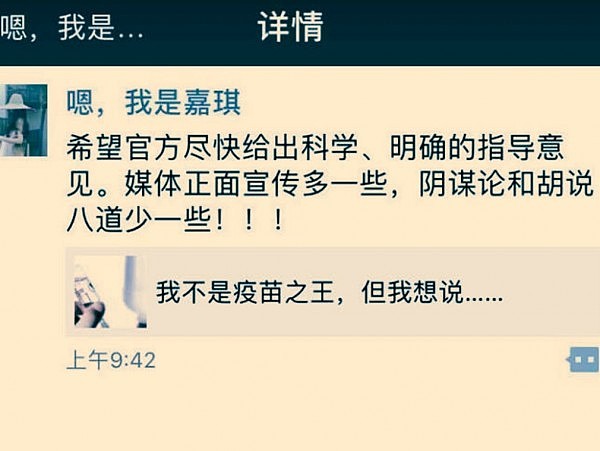
网传,此内容是长春造假疫苗公司董事长儿媳所发(图源:@隋嘉琪_Athena)
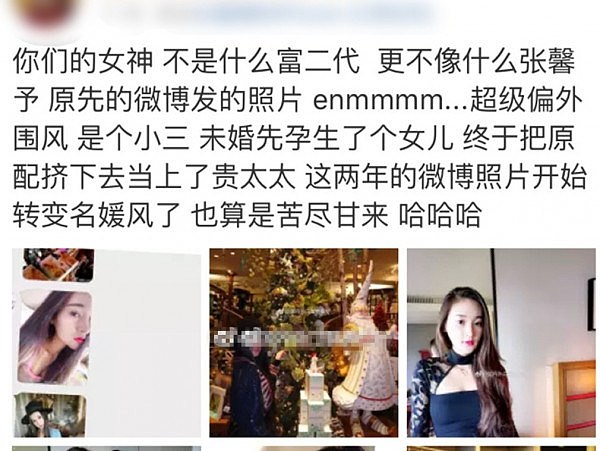
长春造假疫苗公司董事长儿媳在网上炫富(图源:@国内外白富美揭秘)

近日,中国长春长生生物科技及其公司相继爆发狂犬病问题疫苗和百白破联合问题疫苗等事件,引发中国民众恐慌。随后,曾主管中国药品安全的孙咸泽也遭到中国网友的热议(图源:@真正空空如也)
长生生物疫苗生产造假板上钉钉,除此之外,长生生物在疫苗销售环节,同样也是腐败丛生。
2017年全年,长生生物的销售费用达到5.83亿元,相比2016年的2.31亿元增幅达到1.52倍,并且在长生生物上述5.83亿元的销售费用中,推广服务费占了绝大部分,超过4.42亿元,是总销售费用的75.95%。不过值得注意的是,该公司销售团队仅有 25 人。据了解,2016年中国颁布《疫苗流通和预防接种管理条例》后,官方要求过滤掉层层经销环节,从企业到县级疾控中心,只能开一张增值税发票。疫苗经销商的销售资质被取消,但实际上经销商并未真正消失,而是成为了具备资质的经营推广商,在长生生物的巨额销售费用中,就包含了这群人的巨额渠道费。
据公开资料显示,中国每年的疫苗使用以亿计量,对应的就是疾控中心、基层卫生院的各种采购订单。与疫苗有关的贪腐类案件大量存在,除了研发和生产环节的贿赂行为,基层疾控中心和卫生院的腐败案件占到了疫苗类腐败案件的50%以上。最为常见的贿赂模式即销售机构为拿到订单,向基层疾控体系行贿。贪腐为渠道护航,也为造假疫苗的肆虐铺平了康庄大道。
监管在整个疫苗生产和流通的环节里,是否又存在缺位呢?
据了解,中国从2001年起开始实施和完善疫苗批签发制度,国家食品药品监管部门依据法律规定主管全国疫苗批签发工作,并指定承担疫苗批签发检验或审核工作的药品检验机构。
2006年,中国即实现对所有疫苗的批签发管理,目前每年签发疫苗约5,000批次,7亿剂量单位。2006年至2017年期间,共拒签各类不合格疫苗317批,共约1,900万人份。
中国国家药品监管部门每年组织对疫苗生产企业的全覆盖检查。一是按照药品GMP要求、中国药典要求、注册标准要求对疫苗生产质量控制进行跟踪检查。二是根据批签发、国家抽验、不良反应监测等收集到的风险信号开展飞行检查。2008年以来,食品药品监管部门每年对部分疫苗开展评价性抽验,即从生产、流通和使用三个环节抽取疫苗产品进行质量检验和结果分析,结果显示,其共抽检疫苗产品944批次,合格率99.6%。
2011年中国疫苗监管体系通过世界卫生组织(WHO)的国家监管体系评估,该评估既是对一个国家疫苗监管机构能力的全面考量,也是该国疫苗生产企业申请WHO产品预认证并进入国际采购渠道的基础和前提。不过据《第一财经》采访业内人士表示,中国国产疫苗不管是监管层,还是疫苗生产企业,相比国际通行水准,还有很大的提升空间。在质量检验上已经与国际接轨,对疫苗采取三次抽验的方式进行评价性抽验,但差别在于通过抽验的标准。
“目前我国仅需3次抽验中有1次合格即被视为抽验通过,但在国际上,很多国家采取的是3次抽检必须全部通过,有一次不过便不予签发。”该业内人士表示。并且在问题疫苗的处理上,中国与国际上的处理方式也有差别,“目前对抽检不合格的批次,国内仅要求处理同批次疫苗,但国际上在问题疫苗原因未明的前提下,则会对发现问题疫苗的前后3~5个批次停止销售和使用,并进行复检。”
不仅监管标准有出入,监管层处罚力度也不强。就此次长生生物疫苗事件的处罚而言,违法违规生产的冻干人用狂犬病疫苗,由于尚未出厂和上市销售,仅作出收回该企业《药品GMP证书》责令停止狂犬疫苗的生产的处罚决定。而在去年11月被发现的“百白破”问题疫苗,在共计25万支流入市场的前提下,仅做出了没收库存同批次疫苗186支,并处罚款总计344万元的处罚决定。
并且此次事件中,尤其令人惊讶在于,去年10月,长春长生生产的百白破联合疫苗就在中国食品药品检定研究院的药品抽样检验中被检出效价指标不符合标准规定,而吉林省食品药品监督管理局直到半年后的今天,才对长生生物下发行政处罚决定书。在此种监管力度下,加之违法成本偏低,无疑也是中国国产疫苗现状的弊病所在。 中国从20世纪70年代中期,开始在全国范围内开始实行计划免疫,主要内容最初可概括为“四苗防六病”,即7周岁及7周岁以下儿童进行卡介苗、脊髓灰质炎三价疫苗、百白破混合疫苗和麻疹疫苗的基础免疫及以后适当的加强免疫,使儿童获得对结核病、脊髓灰质炎、百日咳、白喉、破伤风和麻疹的免疫。
2007年,中国政府对计划免疫的疫苗品种进行了大规模的扩展,在“五苗七病”基础上又增加到预防15种传染病的14种疫苗,新增了甲型肝炎疫苗、乙脑疫苗、流脑多糖疫苗、风疹疫苗、腮腺炎疫苗、钩体病疫苗、流行性出血热疫苗和炭疽疫苗。免疫计划也催生了疫苗产业,据中国食品药品检定研究院副院长王佑春介绍,中国共有45家疫苗生产企业,可生产63种疫苗,预防34种传染病,年产能超过10亿剂次,是世界上为数不多的能够依靠自身能力解决全部计划免疫疫苗的国家之一,并且中国国产疫苗约占全国实际接种量的95%以上。
事实上,中国是为数不多可以不依赖外企,或者说本国企业与外资药企的疫苗商具有竞争实力的国家。但千里之堤毁于蚁穴,疾控是民生大事,接连的疫苗事件已经造成了公众信任危机,如果进一步影响疫苗的接种率,那么公共健康将会存在更大的风险,历史上,英国就层发生过大范围的“疫苗抵制”,结果那些抵制的地区无一例外的爆发了严峻的疫情。接下来中国能否避免同样的悲剧重演?









 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


