君实扔下重磅炸弹!中国首个PD-1美国获批(组图)
中国PD-1出海终于迎来首款落地美国产品。
2023年10月28日早间,Coherus BioSciences与君实生物共同宣布,美国FDA正式批准特瑞普利单抗与顺铂和吉西他滨联合用于一线治疗成人转移性或复发性局部晚期鼻咽癌。及其单药获批用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。
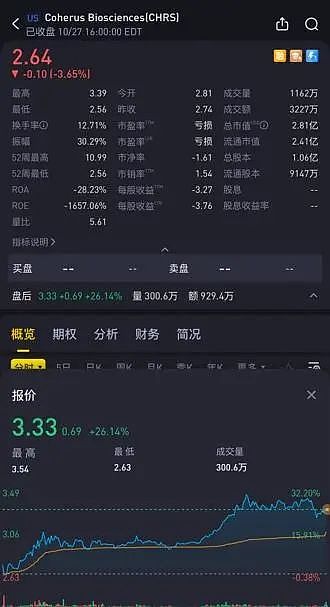
受此积极消息影响,Coherus股价在盘后大涨超26%。
Coherus 预计将在2024年2月1日,向君实生物支付2500万美元的里程碑付款。
对中国创新药品的国际化步伐来说,君实生物的特瑞普利单抗得到FDA的绿灯无疑是具有里程碑意义的一刻。
它不仅荣誉地成为首款获得FDA批准用于治疗鼻咽癌的药物,同时也是经过一波三折后,首款赢得FDA认可的国产PD-1抗体药物。

中国PD-1为何要进入美国?
进入美国市场的意义何在?对于中国的药厂而言,FDA是一块试金石。一方面,拿到FDA的认证,是对产品质量的肯定;另一方面,进入美国市场,意味着更为丰厚的利润回报,避免像在本土市场上与众多竞争者厮杀至价格低谷。
回溯日本药企的成长脚印,不难发现,正是通过在美国市场学习成长,它们逐渐壮大,成为国际知名药企巨头。美国市场对药品的支付价位相对较高,为药企带来了更可观的回报率,进而刺激了更多的资金投入研发,推动了企业的持续发展。
对中国药企而言,踏足美国市场就像是开启了一个新的游戏关卡,每一次的“打怪升级”,都是对其实力的一次锻炼,也是向全球化迈进的一大步。
但中国药企进入美国,尤其是PD-1产品充满了波折。
2022年2月,信达生物首款国产PD-1冲击在美国上市失败。对产业界和投资界信心有了很大冲击。
当时,信达生物与合作伙伴礼来采用中国3期临床数据,报批非小细胞肺癌。但是最终结果是,FDA独立的肿瘤药物咨询委员会(ODAC)认为,对于在美国上市的大癌种适应症,需要有美国人群不同民族、种族的临床数据。此外,对于已经有同类产品上市的背景下,临床对照组应选择头对头,并且在临床终点选择上应与美国要求一致。
最终,FDA要求信达/礼来需要补做美国3期临床。而这项3期临床不仅开销巨大,而且耗时将超过3年,不再具有商业化意义,信达生物PD-1出海就此结束。
华尔街见闻·见智研究曾在文章《首个国产PD-1今日“上会”FDA,为什么整个医药行业都关注它?| 见智研究》对此有过深入分析。彼时,FDA认为监管灵活性,应该在亚洲更常见的疾病的大型临床试验中,比如肝细胞癌或鼻咽癌等。
目前国内PD-1使用国内数据在美国申报上市有两种情况,一种是针对美国的大适应症,如信达就是采用肺癌适应症上市(已经被证明FDA不认可,此外还有基石也被证明出海失败);另一种是采用鼻咽癌、食管鳞癌、肝癌等在美国是小适应症,但在中国更常见的疾病申报上市,如君实、百济、恒瑞、和黄等。按照FDA的指导原则,后一种情况监管将更灵活。
美国每年新增鼻咽癌0.22万例,其中新增复发/转移性鼻咽癌0.15万例,特瑞普利单抗针对鼻咽癌适应症此前获得孤儿药资格。
此次君实生物特瑞普利单抗正是使用亚洲人(270例中国大陆、19例台湾+新加坡)数据,符合美国“未被满足的临床需求”条件,成功豁免美国本土临床数据而获批上市。
这证实采用上述第二种方式能够获得FDA批准上市,也为中国创新药出海探明了一条新路。这对恒瑞类似的双艾针对肝癌适应症的FDA申报是同样的好消息。

君实生物PD-1获批的一波三折
不过,君实生物此次出海也是一波三折。
2021年3月,君实生物公告宣布向FDA递交特瑞普利单抗的滚动上市申请,成为首个向FDA递交生物制品许可申请(BLA)的国产PD-1药物。
到了10月,FDA就该BLA授予优先审评认定,并且不计划安排ODAC会议,拟定的处方药用户付费法案(PDUFA)目标审评日期为2022年4月。
2022年5月,君实生物公告称,收到FDA寄发的一封关于特瑞普利单抗BLA的完整回复信,回复信要求进行一项公司认为较容易完成的质控流程变更。
2022年7月,美国FDA受理了君实的特瑞普利单抗重新提交的针对两项鼻咽癌适应症的BLA,PDUFA的目标审评日期定为2022年12月23日。
2022年12月,君实生物公告称,截至PDUFA的目标审评日期2022年12月23日,尚未收到FDA有关上市申请的审评结论函。
此次推迟主要因为新冠旅行限制,FDA无法进行现场检查,同样原因被推迟的还有百济神州。
2023年5月中下旬,美国FDA完成了对特瑞普利单抗的生产现场核查,并发出了Form 483。彼时,市场对Form 483态度消极,认为影响很大。见智研究在《君实PD-1出海再进一步 | 见智研究》中对Form 483做了深入解释,并认为对最终结果并无太大影响。
2023年9月下旬,合作方Coherus表示,FDA已完成对中国三个临床中心的临床研究现场检查。这些临床中心正是两项此次获批临床的承担单位。
最终,2023年10月28日,在FDA周末下班前最后一刻,批准了特瑞普利单抗。

疗效优异,合作方对销售信心满满
Coherus在电话会中也表示了对君实特瑞普利单抗的乐观预期,认为它在鼻咽癌适应症的峰值销售额将达到2亿美元。同时表示,在指南推荐的背景下的唯一适应症产品,将有一个有力的定价策略。
Coherus信心如此之强的原因就在于,君实特瑞普利单抗在数据上确实表现亮眼。
在JUPITER-02的3期研究中,特瑞普利单抗联合化疗显着改善了无进展生存期 (PFS),与单独化疗相比,疾病进展或死亡风险降低了48%。特瑞普利单抗还证明了总体生存率 (OS) 具有统计学意义和临床意义的改善,与单独化疗相比,治疗可使死亡风险降低37%。
在POLARIS-02临床研究中,特瑞普利单抗在既往化疗失败的复发性或转移性鼻咽癌患者中表现出持久的抗肿瘤活性,客观缓解率 (ORR) 为20.5%,疾病控制率 (DCR) 为40.0%,中位缓解率OS为17.4个月,安全性可接受。
凭借优秀的数据,在美国之外的欧洲,君实也有望获批。2022年12月和2023年2月,欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)分别受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请。
特瑞普利单抗在FDA获批不仅仅是对君实生物的肯定,更是对中国药企在创新药研发领域努力的有力回应。但特瑞普利单抗在美国最终销售情况如何,还得Coherus用实际行动来验证。
不过,特瑞普利单抗的获批的确为中国创新药在国际舞台上敲开了一扇门,以君实PD-1与传奇生物CAR-T和百济神州BTK为代表的先驱者,同时也为其他寻求国际认可的中国药企划定了成功的范例。
让我们共同期待百济神州、恒瑞、和黄等公司再次带来更多中国创新药出海好消息。







 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


